認知症専門外来
認知症について
超高齢社会とは
高齢化率(65歳以上人口割合)が全国民の内7%以上となった社会を「高齢化社会」といいますが、14%となった社会は「高齢社会」と呼びます。さらに21%以上となった社会を「超高齢社会」と言います。日本では2007年に高齢化率が21%を初めて超え、超高齢社会となっています。厚生労働省によると2021年の日本人の平均寿命は男性81.47才、女性が87.57才となっており、日本の高齢化率は世界一です。すなわち世界一の長寿国であり、それに伴い、認知症者比率(有病率)も世界一となりました。
認知症の頻度
高齢社会に伴って認知症患者の数は急増しています。日本における65歳以上の認知症の数は2020年で約600万人と推計され、2025年には約700万人となり、高齢者の約5人に1人が認知症になると予測されています(図1)。
また認知症の前段階であるMCIの数は400万人と推計されています。両者を合わせると、900万人以上とも言われており、高齢者の4人に1人が認知症しくはMCIであることになります(図2)。
認知症の治療や社会的損失のコストの総計は年50兆円以上になるとされており、認知症対策を適切に行う必要があります。
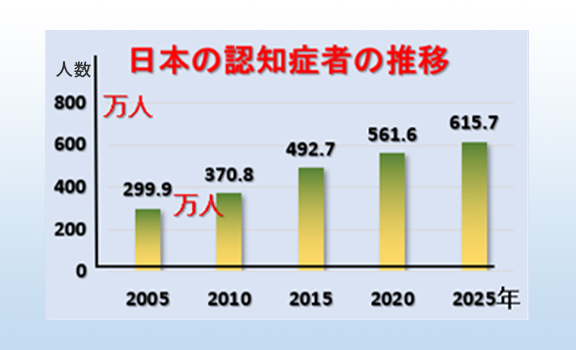
図1 我が国の認知症者の数
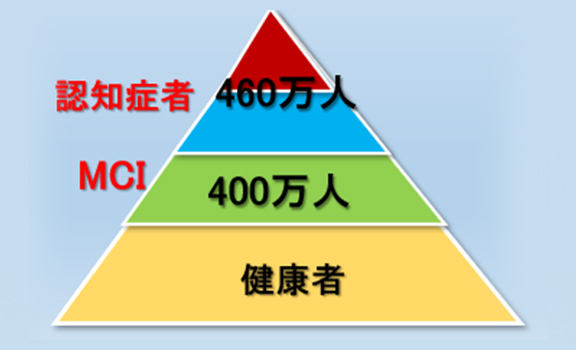
図2 令和2年の認知症者とその予備軍の数
認知症の種類
認知症には主に、アルツハイマー型認知症、レビー小体型認知症、脳血管性認知症、前頭側頭型認知症があります。もっとも多い割合を占めるのがアルツハイマー型認知症で全体の約60%を占めます。2番目に多いのが、脳血管性認知症で約20%です。続いて、レビー小体型認知症が約10%、その他10%が、前頭側頭型認知症などの非アルツハイマー型認知症などです(図3)。
認知症になると、大切な記憶が少しずつ失われ、単純な計算や日常動作ができなくなり、妄想・徘徊・暴言などを繰り返すようになり、やがては家族の顔も、自分が誰なのかも分からなくなり、もうろうとしたまま寝たきりの最期を過ごす様になります。60代では3%程度と認知症の発症率はそこまで高くありません。70代の後半では男性12%・女性14%、80代後半になると男性35%・女性44%と大幅な増加が見られます。90代の後半ともなると、男性の51%・女性の84%もの割合で認知症が発症するという結果が出ています。要するに高齢になればなるほど認知症を患う頻度が増加します。できれば、生涯認知症とは無縁のまま、人生の最後まで頭がハッキリとした状態で自分らしく過ごしたいというのは、人類共通の願いであろうと思います。
20年以上前までは認知症の頻度は1位が脳血管性認知症でしたが、現在では、アルツハイマー型認知症が1位となっています。その理由として、高齢化に伴ってアルツハイマー型認知症が増加してきたこと、降圧剤や脳循環改善薬が普及してきたこと、診断能力が著しく向上してきたこと、さらには脳血管性認知症と思われた症例の中に、多数のアルツハイマー型認知症が含まれていたことなどがあります(図4)。
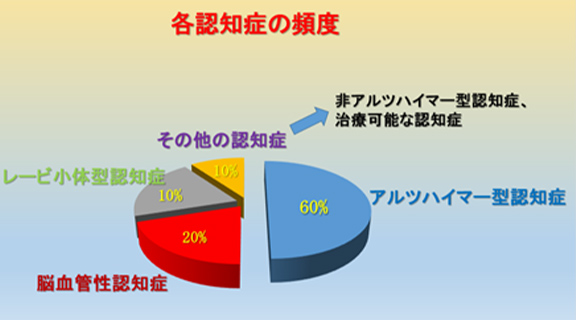
図3 各認知症の頻度
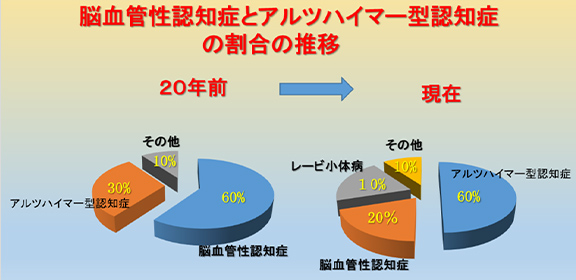
図4 脳血管性認知症とアルツハイマー型認知症の割合の推移
治療可能な認知症
治療可能な認知症として以下の様な疾患があります。
このような認知症は治療により改善が見込めますので、これらを発見することは大変重要です。
脳血管障害
脳出血~脳梗塞、多発性脳梗塞、クモ膜下出血、ビンスワンガー病、アミロイド血管症、モヤモヤ病、動静脈奇形など
頭蓋内腫瘍
原発性脳腫瘍、癌の転移
頭部外傷
脳挫傷後後遺症、慢性硬膜下血腫、外傷後正常圧水頭症
感染症
脳炎及び髄膜炎、梅毒、クロイツフェルトヤコブ病、亜急性硬化性脳炎、進行性多巣性白質脳炎、エイズ等
中毒性疾患
アルコール中毒、重金属による中毒
代謝性疾患
肝性脳症、ウイルソン病、ポルフィリン症、ニュ独唱、高Ca血症、低血糖症
内分泌疾患
甲状腺機能低下症、アジソン病、クッシング症候群、下垂体機能不全、副甲状腺機能低下症
低酸素脳症
高度貧血、うっ血性心不全、慢性肺疾患、一酸化炭素中毒
治療困難な認知症
治療困難な認知症にもアルツハイマー型認知症以外にもタウタンパク病など脳の変性疾患等がありますが、ここではアルツハイマー型認知症について述べます。
アルツハイマー型認知症について
Alois Alzheimer(1864~1915)はフランクフルト市立精神病院勤務などを経て、ミュンヘン大学に勤務。1901年に診療した、嫉妬妄想・記憶力低下などを主訴とする女性患者の症例を1906年に南西精神医学会に発表し、この症例が後に「アルツハイマー病」、現在のいわゆる「アルツハイマー型認知症」と呼ばれる疾患の多くを占めるものとして広く認知されるとともに、多くの医学・薬学研究者の生涯の研究テーマとして現在も主流となっています。
30年前まではアルツハイマー病という疾患は主として若年者にみられるもので滅多にない遺伝性の疾患と思われていましたが、現在では脳の病理で脳内に老人斑(アミロイドβタンパク)の沈着とβタンパクの周囲で神経原線維変化(チリチリにねじれた線維、すなわち高度にリン酸化したタウ蛋白のこと)が見られるものを総称して言われています(図5)。
アルツハイマー型認知症の原因、病態は十分には解明されていませんが、近年、老人斑はアミロイドベータ蛋白、神経原線維変化は高度にリン酸化されたタウ蛋白で構成されていることがわかっています。アミロイドβタンパクとは老人斑を構成する主成分であり、その前駆体(アミロイド前駆体蛋白(APP))から切り出されて産出され、神経の成長と細胞膜の修復をする役割があるとされていますが、細胞膜においてガンマセクレターゼと言う酵素で切断され、神経細胞内でアミロイドベータ40,42となり、これらは水に不溶性の毒性物質であり、凝集の結果脳内に蓄積されてゆきます。これらの蓄積により神経細胞のニューロンが過剰にリン酸化を受け、最終的に神経原線維変化を来し、正常の神経細胞が減少、消滅することで発症するとされています(図6)。
これはアミロイドカスケード仮説といわれ、現在で最も多く支持されています。この神経細胞死は当初、短期記憶を担う海馬周辺から始まり、次第に脳全体に広がって認知機能障害が強くなっていきます。
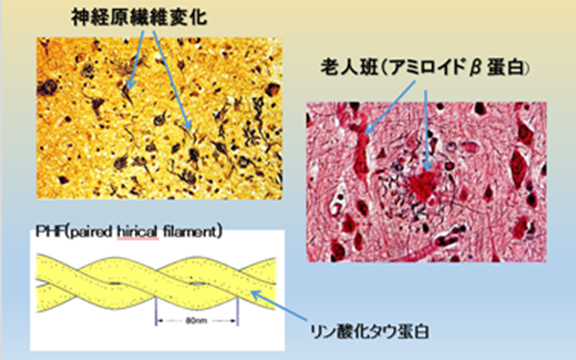
図5 アルツハイマー型認知症の脳病理
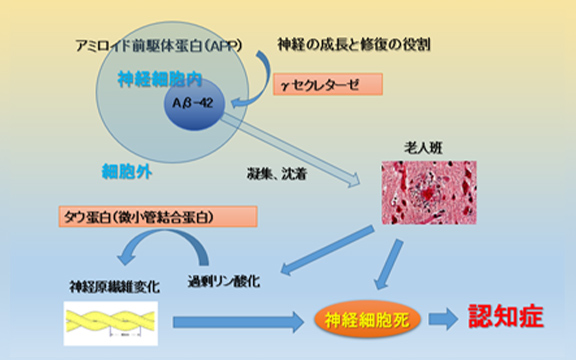
図6 βタンパクと神経原繊維変化の現在考えられている機序
アルツハイマー型認知症の簡易検査について
アルツハイマー型認知症のチェックとして各医療機関では長谷川式認知症検査(HDS-R)やミニメンタルステート検査(MMSE)を行います。これらの認知テストでは記憶、言語、問題解決能力や計算、注意能力の検査が行われます。採点結果により27/30点以上は正常、23点~27点は軽度認知症疑いとし、23点以下は認知症あるいは認知症疑いと言われています。しかし一般的に認知症は、前頭葉機能低下が先に起こると言われており、MMSEが27点以上でも前頭葉機能検査であるFABを行うと 13/18点(14点以上はほぼ正常)以下の事もしばしばあり、注意が必要です。そのため当院ではMMSEとFAB検査の両方を行っています。
MMSE(Mini-mental state examination:認知機能スクリーニングテスト).PDF認知症における老人班と神経原線維変化の時間的関係
現在の抗認知症薬は、認知症状が出てから検査を行い、診断後、開始となっています。80才前後で発症したとすると、その時期より抗認知症薬が開始となります。アミロイドβタンパクが出現し始めるのは認知症発症の30年前頃と言われていますので、すなわち50才前後から老人斑が脳に沈着することになります。神経原線維変化が生じ始めるのは、老人斑出現からさらに10年後と言われており、70才前後で脳の神経細胞死が生じているため、70才前後で軽度認知障害(MCI)が始まり、70才を過ぎると本格的に認知症の症状が現れてきます。
そのため、80才前後で投薬開始するのは少し遅すぎると思われます。そうなると早期診断のためには50才前後で何らかの新しい認知症診断を行い、アミロイドが沈着しないようにする必要があります。最近ではPETを用いてアミロイドの沈着を見ようとする方法(アミロイドイメージング)があり、高感度に画像化できるように開発がすすめられています(図7)。
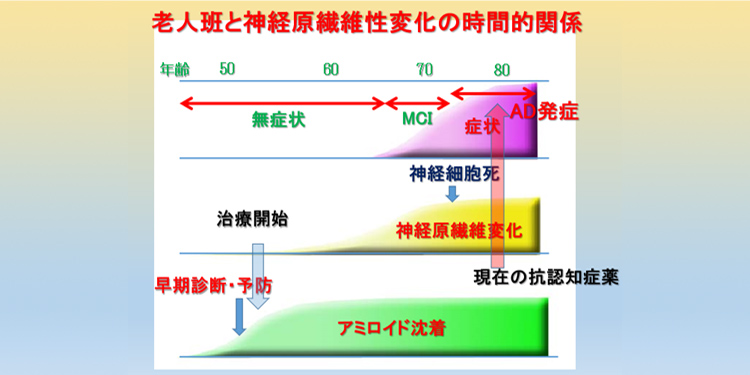
図7 老人班と神経原繊維変化発生の時間的関係
アルツハイマー型認知症の画像所見
MRI検査
前頭~頭頂葉の大脳皮質の萎縮が生じ、脳室は拡大し、海馬及びその周辺の萎縮が目立つようになります。VSRAD(Voxel-based Specific Regional analysis system for Alzheimer’s Disease)は、記憶に関わる部位である海馬傍回(かいばぼうかい) 、海馬、扁桃体の萎縮度を痛みもなく簡単に調べられるMRI検査です。この領域は主として短期記憶を担っているとされ、この検査では、これらの部位の萎縮度をテストしアルツハイマー型認知症の可能性を数値化します。VSRADが概ね1.5以上の場合は海馬の萎縮が全体脳に比べ進行しているとされています(図8)。
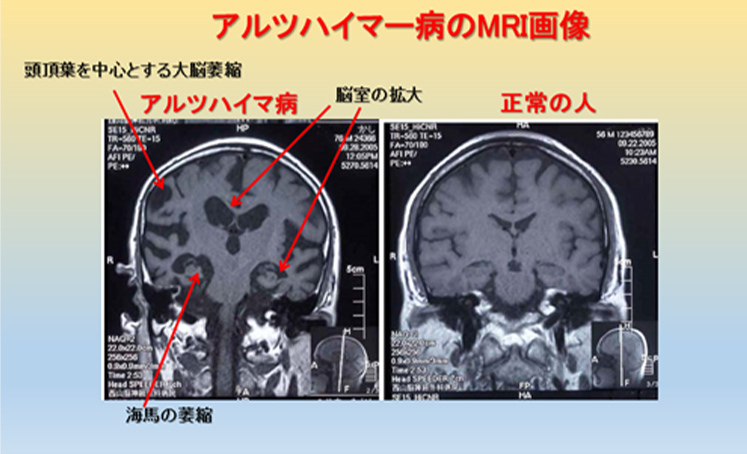
図8 アルツハイマー病のMRI画像
生活習慣病と認知症
厚生労働省によると、生活習慣病とは、食習慣、運動習慣、休養、喫煙、飲酒等の生活習慣がその発症、進行に関与する疾患群とされています。糖尿病、脂質異常症、高血圧など多岐にわたります。生活習慣病は認知症のリスクを高めると言われています。高血圧や糖尿病、脂質異常症は動脈硬化を促進し、脳血管障害を来し、脳血管性認知症を発症すると言われています。すなわち、脳血管性認知症はアルツハイマー型認知症の発症のリスクを高めると言われています(図11)。
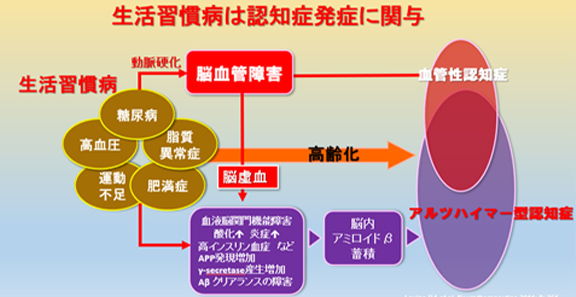
図11 生活習慣病は認知症の発症に関与
認知症の周辺症状について
中核症状が本来の性格や本人を取り巻く環境などに影響して現れ、妄想、抑うつ、興奮、徘徊、不眠、幻覚、意欲の低下などの精神機能や行動の症状を、周辺症状あるいはBPSD(Behavioral Psychological Symptoms of Dementia )と言います。認知症の症状がある程度進行するとBPSDが出やすくなりますが、体調が悪い場合、例えば、便秘が続いたり、食欲がなかったり、介護をしている方の言葉が気に入らなかったり等でBPSDの症状が出現したり、消失したりします。
最近、漢方薬の効果が注目され、中でも抑肝散(よくかんさん)は認知症の幻覚、興奮・攻撃性、焦燥感・易刺激性、異常行動において効果が期待できると言われています。薬物治療として抑肝散などの効果がない場合には抗精神薬を加味しなければならない場合もあります(図12)。
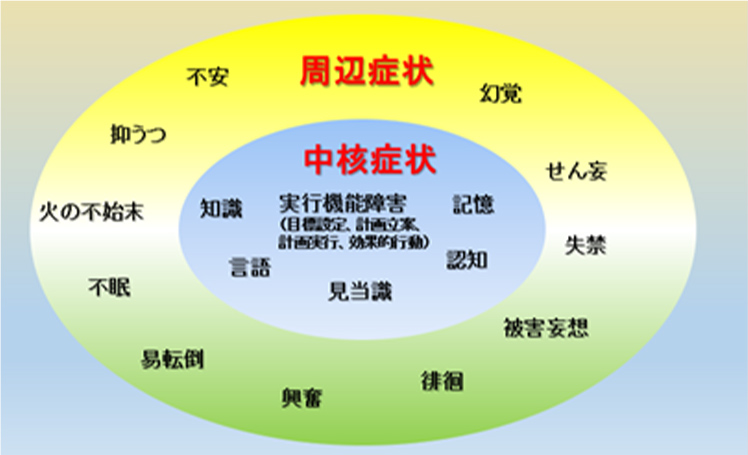
図12 認知症の中核症状と周辺症状
脳のゴミ処理機構と睡眠(グリンファティックシステム)
グリンファティックシステムとはグリア(神経膠細胞、多くは星状細胞)とリンパを組み合わせた言葉です。循環系で血液を運ぶのは動脈や静脈です。血液の一部は全身の毛細血管壁を通して組織間隙~細胞間隙に入り、組織液の一部は毛細リンパ管に流れ込みます。脳の神経細胞も活動すれば老廃物が発生します。老廃物がたまればニューロンの働きが悪くなり様々な障害を引き起こすようになります。例えばアミロイドβタンパクは神経の活動に伴って生じる老廃物と考えられます。βタンパクの脳内への蓄積がアルツハイマー型認知症の原因とされています。アストロサイト(グリア細胞の一つ)の足突起は、脳脊髄の動脈・静脈・毛細血管を取り囲んでいます。 血管壁とアストロサイトから伸びた足突起から形成される壁構造に囲まれた空間を血管周囲腔と呼びます。 脳内の動脈の拍動や、くも膜下腔の内圧などの力によって、脳脊髄液はくも膜下腔から血管周囲腔に流入します。 アストロサイトには水輸送を担う水チャンネル(アクアポリン)があり、これによって動脈周囲の液は脳の実質内に拡散し、さらに脳の実質内から静脈周囲へと移行します。
アストロサイトの足突起にあるアクアポリン4が水移動を促進し、脳組織の細胞外環境を清掃する役割を担っています。睡眠中に脳細胞(グリア細胞であると推測されている)の体積が縮小して間質腔が拡張します。 そうすると脳脊髄液が脳組織を通過しやすくなり、睡眠中に脳の間質に存在する老廃物が効率的に除去されます。 多くの人は睡眠不足のときに集中力の低下や記憶力の低下を経験しますが、グリンファティックシステムの機能低下による老廃物の蓄積がその一因かもしれません。睡眠が十分取れていない人では脳内のβタンパクが十分に排泄されないため認知症が進行しやすいのかもしれません。
認知症の治療について
薬物療法
認知症に対する薬物療法は大きく分けて、中核症状の進行を抑えることをねらいとした認知機能改善薬によるものと、行動・心理症状の軽減をねらいとした向精神薬や睡眠薬によるものとに分けられます。
1)アセチルコリンエステラーゼ阻害薬
アセチルコリンとは、脳内では記憶保持や集中、覚醒などの作用がある神経伝達物質です。アセチルコリンエステラーゼ阻害薬はアセチルコリンの分解を抑制し、脳内の相対的濃度を高めることで、アルツハイマー型認知症やレビー小体型認知症の中核症状の進行を抑制するとされています。主にアルツハイマー型認知症の軽度~中等度の段階を中心に幅広く服用されています。
一方で、アセチルコリンは全身に幅広く作用する神経伝達物質なので、特に薬物が最初に吸収される消化器に作用し、副作用として吐き気や下痢、食欲不振があらわれることがありますので、そのような症状があれば中止が必要です。運動器ではふらつきなどの歩行障害がみられています。また、精神的な副作用として攻撃性の増加や興奮があり、暴言や暴力などにつながることがあるため、注意が必要です。アセチルコリンエステラーゼ阻害薬として現在日本で認可されているのはドネペジル、ガランタミン、リバスチグミンで、全て同じ作用の薬物です(図13)。
消化器の副作用が出やすい場合には、シールのように皮膚に貼りつけて吸収させる、リバスチグミンのパッチ剤を用いるなど使い分けることがありますが、パッチ剤と経口剤を併用することはありません。皮膚に貼付するパッチ剤では湿疹などのアレルギー反応が出ることがあり、その場合は貼付の中止や抗アレルギー剤の投与が必要です。
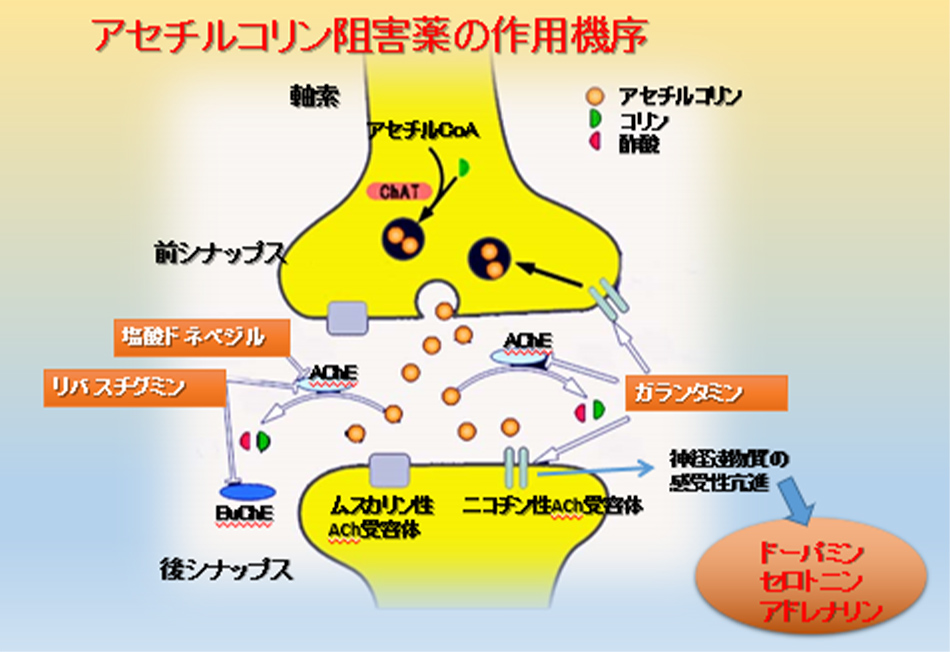
図13 アセチルコリンエステラーゼ阻害薬の作用機序
2)NMDA受容体拮抗薬
グルタミン酸は脳内の興奮性の神経伝達物質です。NMDA受容体拮抗剤がグルタミン酸の作用を弱めることで、過剰な興奮による脳神経の損傷を抑え、中核症状の進行を抑制するといわれています。比較的重度の認知症にも用いられ、興奮を抑制する作用もあることから、行動・心理症状の興奮や暴言・暴力などの攻撃性に対する効果も期待されています。現在、日本ではメマンチンが認可されています。副作用としては主にめまいや眠気が報告されています。NMDA受容体拮抗剤とアセチルコリンエステラーゼ阻害剤とは効果をもたらすしくみが異なるため、これらが併用されることもあります。
3)抑肝散などの漢方薬
抑肝散は、イライラした気持ちを落ち着かせ、不安や妄想、暴力などを抑える効果があるとされている漢方薬です。レビー小体型認知症や薬への過敏な反応がある人に対して処方されることもあります。後述する向精神薬よりも作用が穏やかで、重篤な副作用が生じづらいとされています。抑肝散は子供では夜泣き、疳の虫などでよく処方されてきました。大人でもよく使われており、効果も良好です。副作用として低カリウム血症が生じることがあります。症状としては脱力感、手足のだるさ、不整脈や筋肉痛、筋肉のけいれんなどがあり、数か月おきに血液検査が必要です。
4)向精神薬,抗てんかん薬
異常な興奮や焦り、幻覚や不安などの行動・心理症状に向精神薬が用いられることがあります。これらの症状は当然ご本人にもご家族にも辛いため、やむを得ず使用する場合もありますが、現在では第一選択としてこうした薬物を使用されるべきではないとされています。また、向精神薬に限らず、高齢者は薬物を分解、代謝する能力が低下しているため副作用が生じる可能性が非常に高く、他疾患で服薬している場合、多種多剤の服薬にリスクがあるからです。そもそも、向精神薬の作用は個人差が非常に大きく、各自の適量は慎重に調整される必要があります。思いがけず強い副作用を生じる場合もあり、例えば、鎮静作用が強すぎて会話や身動きもできない状態になり、うまく食事を飲み込めない嚥下障害という重篤な副作用があらわれることさえあります。このため、興奮や焦り、不安などの症状があっても、向精神薬はかなり慎重に服用させ、効果があれば早めに中止する必要があります。
5)睡眠薬、睡眠導入剤
不眠に対して使用されます。睡眠が十分とれないと、不眠により日中にぼんやりし認知機能が落ちる、昼夜逆転し夜間に不安に駆られ大声をあげるなど、生活の質に大きくかかわるため、睡眠薬が使用されることがあります。一方で、夜間にトイレに起きた際にふらつき転倒したり、翌朝にも効果が残り居眠りをしたり、せん妄状態になるなどの副作用もあります。
非薬物療法
薬物を使わない治療法もまた、認知症の進行を止めたり、根本的に治療したりするものではありません。しかし、生活の質を上げるという面では薬物療法以上の効果も期待されます。例えば、認知症の症状による不安や妄想に苦しむ方も、昔からの趣味などに集中していれば、その時間は不安が少なく、その方らしく過ごしていられます。
1)認知症のリハビリテーション
いわゆる脳のトレーニングと呼ばれるゲームやパズル、計算ドリルなどを使用した学習療法、書籍の音読、麻雀など、一般的に頭を使うとされる活動を行うことにより、認知機能の維持や回復を目指すものです。私たちの生活は、調理や掃除などの家事、職場での労働、趣味の活動などの「作業」に満ちています。そうした「作業」をリハビリや治療の方法として活用するのが「作業療法」です。作業療法では調理や手芸、園芸など、日常生活の作業を通して、心身の機能の維持や強化、幸福感や自尊心の充足、人々や社会とのつながりの回復などをはかります。その結果、心と体のリハビリテーションの効果が得られます。また、入退院など心身の状態や環境に変化があった際、ご自宅の環境を調整して、新しい福祉用具を活用できるよう支援することにより、新たな適応を促進する効果もあります。
2)園芸療法
見当識障害で時間の感覚が薄れ、季節感や時間による変化の感覚を失いがちな認知症の人にとって、季節を感じさせ日々成長していく植物は、とても心地よい存在です。また、土をいじる、水をやる、花を摘み取る作業などが、昔の記憶や触覚をよみがえらせることもあります。さんさんと降り注ぐ太陽の下で“昔取った杵柄”的な効果が得られます。当院のデイケアでは実際に畑に出かけ、芋ほりや、玉ねぎの収穫、ブドウ、スイカの収穫や、その他の果物の収穫を利用者と実施しています。利用者の生き生きした笑顔を見ると、先生と生徒の関係が全く逆転し、何とも言えないよい気分となります。リハビリ職員が生徒となります(図14,図15)。

図14 園芸療法ジャガイモの収穫

図15 園芸療法ブドウの収穫
3)音楽療法
美しい歌詞や心躍るメロディ、楽曲がもつ時代背景や思い出は素晴らしい刺激となります。言葉がうまく出ない認知症の人でも、歌ならはっきりと歌え、自信を取り戻すことがあります。また、環境からの刺激をうまく分類できず過敏になる認知症の人でも、心地よい曲が流れているだけで不安が解消され、落ち着きを取り戻すこともあります。カラオケも大変効果があります。
4)回想法
認知症初期~中期の記憶障害では、昔の記憶は失われにくい傾向があります。記憶を次第に失うことで自分が自分でなくなるような不安を覚えることも多い認知症の人が、懐かしい写真や映像、音楽をきっかけとして、昔の記憶を思い出し、誰かに伝えることはとても楽しいものです。また、かけがえのない経験を積んだ自分をふりかえることが、楽しむ以上の意義を与えることもあります。それを若い世代に伝えることで、自尊心や喜びを得ることもできます(図16,図17)。

図16 認知症の青春塾における回想法
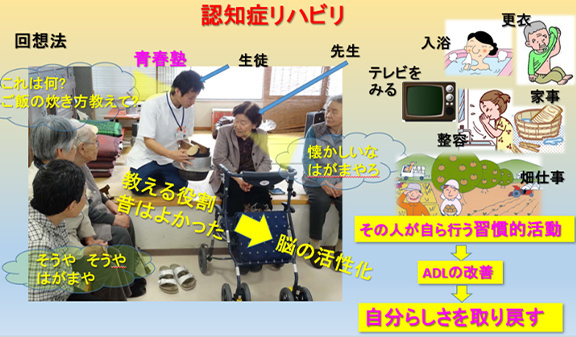
図17 認知症リハビリにおける回想法
5)運動療法
脳の活性化リハビリだけでは、患者さん全体におけるリハビリとは言えません。身体機能の改善もしなければなりません。そのためには体の俊敏さと同時に筋力強化も必要です。当院では上記の脳リハビリに加えてパワーリハビリも取り入れています(図18)。

図18 パワーリハビリ

 English/中国語
English/中国語 救急
救急 地域連携
地域連携 アクセス
アクセス お問い合わせ
お問い合わせ


 診療表
診療表 アクセス
アクセス